Infecção cutânea por numa doente com artrite reumatóide
Published Web Location
https://doi.org/10.5070/D37tt9h4xvMain Content
Infecção cutânea por Mycobacterium chelonae numa doente com artrite reumatóide
Olga Ferreira MD1, Ana Filipa Duarte MD1,2, Teresa Baudrier MD1, Alberto Mota MD PhD1,2, Joana Sobrinho Simões MD3, Filomena Azevedo MD1
Dermatology Online Journal 16 (4): 3
1. Department of Dermatology and Venereology, Hospital de São João EPE, Porto, Portugal. ocsferreira@gmail.com2. Faculdade de Medicina do Porto, Porto, Portugal
3. Department of Microbiology, Hospital de São João EPE, Porto, Portugal
Abstract
There are no pathognomonic findings for cutaneous infection caused by Mycobacterium chelonae. The type and duration of therapy varies considerably among reports and no single antibiotic is considered the treatment of choice. A 61-year-old patient, suffering from rheumatoid arthritis (treated with methotrexate and salazopyrine), presented with violaceous nodules of the right leg that had been evolving for 6 months. She was underwent several skin biopsies. Tissue culture of the last showed an atypical mycobacteria, identified as M. chelonae. Despite improvement after a two-week course of treatment with clarithromycin, a switch to ciprofloxacin was made because of gastrointestinal intolerance. After 3 months, only slight improvement of the lesions was achieved and clarithromycin was reintroduced; significant clinical improvement occurred by the third month. Clarithromycin was continued a further two months until the patient quit on her own and no recurrence was observed. Infections caused by M. chelonae frequently occur in the setting of immunological impairment. Contaminated water is the natural reservoir, but we were unable to establish the source of contamination. As was previously described, there was a significant delay between clinical presentation and diagnosis. Thus, a high index of suspicion and multiple biopsies with culture are of paramount importance to confirming the diagnosis.
Introdução
O género Mycobacterium inclui 95 espécies, sendo as mais conhecidas o M. tuberculosis e o M. leprae. Na década de 30, Pinner denominou as outras micobactérias como atípicas [1]. Estas podem, ainda, ser denominadas como inominadas, ambientais ou oportunistas [2, 3]. De um modo geral, são pequenos bacilos “acid-fast,” sem mobilidade, que se podem dividir em dois grupos, um de crescimento rápido e outro de crecimento lento. Estes agentes podem causar infecção pulmonar, linfadenite, infecções da pele e tecidos moles, infecções disseminadas, de catéteres e infecções granulomatosas das articulações, tendões e ossos [3]. Acresce que as infecções causadas por micobatérias não tuberculosas têm assumido uma importância crescente devido à infecção HIV e ao uso de tratamentos imunossupressores [3, 4].
O Mycobacterim chelonae (MC) é uma micobactéria atípica de crescimento rápido que pertence ao complexo Mycobacterium fortuitum-chelonae e, geralmente, encontra-se na água ou no solo [5,6]. A infecção cutânea que produz manifesta-se normalmente como massa subcutânea ou úlcera [7] e ocorre habitualmente num contexto de imunossupressão [8].
Caso clínico
Uma doente de 61 anos de idade recorreu à Consulta de Dermatologia por nódulos violáceos da perna direita, com 6 meses de evolução. Referia história prévia de artrite reumatóide, tuberculose óssea e mieloma múltiplo. A artrite reumatóide foi diagnosticada aos 29 anos de idade e encontrava-se em tratamento com metotrexato e salazopirina, A tuberculose óssea foi diagnosticada aos 52 anos, por biópsia de massa esternal, e foi submetida a tratamento anti-bacilar durante 1 ano. Aos 54 anos foi-lhe diagnosticado mieloma múltiplo, tendo sido submetida a auto-transplante de medula óssea, seguida de remissão completa.
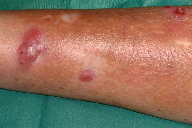
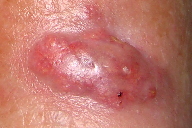 Figura 1
Figura 2
Figura 1
Figura 2
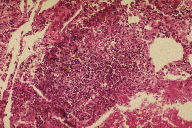
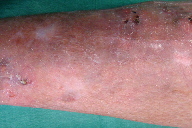 Figura 3
Figura 4
Figura 3
Figura 4
A dermatose iniciou-se após traumatismo da perna direita consequentemente a contacto com objecto metálico (no forno da casa de campo), com aparecimento de pápulo-pústula. A doente negou contacto com água contaminada, assim como hábitos de pedicure e, ainda, a existência de soluções de continuidade nos membros. Negou ainda a existência de lesões prévias nos membros. Posteriormente, a doente refere que esta lesão aumentou de tamanho e adquiriu um aspecto eritemato-violáceo, com pústulas na superfície, e que surgiram novas lesões na perna direita com características semelhantes. Ao exame físico era possível observar nódulos eritemato-violáceos na perna direita, alguns com pústulas na sua superfície e outros com crostas de pequenas dimensões (Figuras 1 e 2). A biópsia cutânea de uma das lesões revelou áreas de necrose e abcedação, acompanhadas de denso infiltrado inflamatório neutrofílico (Figura 3). Estes achados foram compatíveis com o diagnóstico de pioderma gangrenoso e foi iniciada injecção intra-lesional de corticóide nas lesões. Apenas uma das lesões melhorou após este procedimento (Figuras 4 e 5), mas com a injecção subsequente as lesões aumentaram de dimensões (Figura 6). No seguimento, optou-se por realizar nova bióspia cutânea para exame histológico e estudo microbiológico. O exame histológico revelou focos de necrose e abcedação na derme, quisto folicular com área de abcesso e a presença de células gigantes (Figura 7). Foi, ainda, isolado Mycobacterium chelonae (MC) no exame de cultura. Instituiu-se terapêutica com claritromicina oral, 500mg de 12 em 12 horas. Após duas semanas de tratamento, verificou-se uma melhoria ligeira das lesões. Contudo, a antibioterapia foi suspensa devido a intolerância gastrointestinal e substituída por ciprofloxacina oral (500mg de 12 em 12 horas). No final do terceiro mês de tratamento com ciprofloxacina, objectivou-se apenas uma melhoria discreta das lesões, pelo que se optou pela reintrodução da claritromicina, desta vez com franca melhoria das lesões (Figura 8), sem intolerância gastrointestinal, e resolução do quadro ao terceiro mês de tratamento. A antibioterapia foi mantida após resolução das lesões, mas descontinuada ao fim de dois meses por iniciativa da doente. Após sete meses de seguimento não se verificou recorrência das lesões.
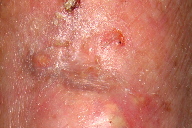
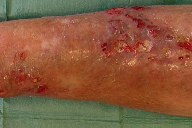 Figura 5
Figura 6
Figura 5
Figura 6
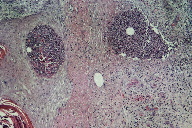
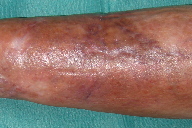 Figura 7
Figura 8
Figura 7
Figura 8
Discussão
As infecções por micobactérias atípicas podem ocorrer na presença ou na ausência de imunossupressão, ainda que sejam mais frequentes na primeira situação. Estão descritos na literatura casos de associação de infecção causada por MC com diferentes estados de imunossupressão, nomeadamente artrite reumatóide [5], doenças auto-imunes do tecido conjuntivo [9], transplantes renal [10] e hepático [6] ou hemodiálise [11]. Na nossa doente, para além da debilidade imunológica provocada pela artrite reumatóide, o uso de metotrexato teve um possível efeito sinérgico no desencadear da infecção.
Habitualmente, o reservatório natural do MC é a água ambiental contaminada. Não estão descritos casos de transmissão inter-pessoal [5]. No caso da nossa doente não foi possível estabelecer a fonte de contaminação, mas as lesões seguiram-se a pequeno traumatismo no domicilio, pelo que a inoculação de origem doméstica é uma possibilidade.
Diferentes padrões histológicos podem ser observados nas infecções cutâneas por micobactérias atípicas. Os mais frequentes são infiltração cutânea granulomatosa, com formação de granulomas tuberculóides, granulomas sarcóides ou nódulos de tipo reumatóide. Podem, também, ser observados abcessos dérmicos ou subcutâneos, infiltração histiocítica difusa da derme ou da hipoderme ou paniculite crónica [2].
Na ausência de achados clínicos ou histológicos patognomónicos, a biópsia cutânea para exame de cultura torna-se fundamental para o diagnóstico e para a determinação da sensibilidade do microorganismo aos antibióticos. Neste aspecto, a polimerase chain reaction (PCR) é um método rápido, sensível e específico no diagnóstico. Contudo, não permite determinar a sensibilidade aos antimicrobianos, pelo que dificilmente poderá substituir completamente o exame de cultura [2, 12]. No entanto, é inegável a sua utilidade na abordagem deste tipo de infecções.
O tipo e a duração do tratamento das infecções por micobactérias não tuberculosas varia consideravelmente nos casos descritos na literatura e nenhum antibiótico ou associação de antibióticos demonstrou poder ser o tratamento de primeira escolha [2]. O MC é resistente aos anti-tuberculosos tradicionais [6, 7, 14]. Contudo, são consideradas alternativas para terapêutica oral desta infecção, a claritromicina (500mg, bid), a azitromicina (500-600mg/d), a ciprofloxacina (500mg, bid) e a doxiciclina (100mg, bid); embora esta última demonstre sensibilidade variável, não devendo por isso ser usada no tratamento empírico. Apesar da duração do tratamento destas infecções não ter sido estabelecida, considera-se como necessário 4 ou 6 meses de antibioterapia, consoante a ausência ou presença de osteomielite.
A monoterapia com claritromicina tem-se mostrado eficaz, mas alguns estudos sugerem que a terapia combinada com outros antibióticos, nomeadamente a ciprofloxacina, poderá ser preferível para evitar a emergência de resistências [6, 7, 14]. De facto, a resposta clínica à claritromicina foi muito satisfatória na nossa doente, tendo-se observado uma diminuição rápida do tamanho e da exsudação das lesões. Na realidade, a nossa doente completou cinco meses de tratamento com claritromicina, sem evidência de recidiva após sete meses de seguimento.
O MC apresenta ainda sensibilidade a alguns antibióticos injectáveis, tais como a tobramicina, a amicacina e o imipinem. Contudo, o seu uso é restrito devido ao seu elevado custo, toxicidade relevante e necessidade de acesso endovenoso prolongado com hospitalização [14].
Há dados que mostram que a incidência das infecções por micobactérias atípicas têm vindo a aumentar, mas a sua verdadeira incidência é provavelmente subestimada. O nosso caso clínico ilustra que são necessários um elevado índice de suspeição e uma história clínica detalhada para alcançar o diagnóstico, o qual deverá ser confirmado por exame histológico e exame bacteriológico dos tecidos afectados.
Referências
1. Pinner M. Atypical acid-fast microorganisms. Am Rev Tuberc. 1935;32:424-452. Dodiuk-Gad R, Dyachenko P, Ziv M, Shani-Adir A, Yehudit O, Mendelovici S, Shafer J, Chazan B, Raz R, Keness Y, Rozenman D. Nontuberculous mycobacterial infections of the skin: A retrospective study of 25 cases. J Am Acad Dermatol. 2007;57(3):413-20. [PubMed]
3. Katoch VM. Infections due to non-tuberculous mycobacteria (NTM). Indian J Med Res. 2004;120(4):290-304. [PubMed]
4. Wagner D, Young LS. Nontuberculous mycobacterial infections: a clinical review. Infection. 2004;32(5):257-70. [PubMed]
5. Forslund T, Rummukainen M, Kousa M, Krees R, Relander A, Katila M-L. Disseminated cutaneous infection due to Mycobacterium chelonae in a patient with rheumatoid arthritis, amyloidosis, and renal failure. Nephrol Dial Transplant. 1995;10(7):1234-6. [PubMed]
6. Nathan DL, Singh S, Kestenbaum TM, Casparian JM. Cutaneous Mycobacterium chelonae in a liver transplant patient. J Am Acad Dermatol. 2000;43:333-6. [PubMed]
7. Ho MH, Ho CK, Chong LY. Atypical mycobacterial cutaneous infections in Hong Kong: 10-year retrospective study. Hong Kong Med J. 2006;12(1):21-6. [PubMed]
8. Wallace RJ Jr, Brown BA, Onyi GO. Skin, soft tissue, and bone infections due to Mycobacterium chelonae: importance of prior corticosteroid therapy, frequency of disseminated infections, and resistance to oral antimicrobials other than clarithromycin. J Infect Dis. 1992; 166:405-12. [PubMed]
9. Douvoyiannis M, Litman N, Dulau A, Ilowite NT. Panniculitis, infection, and dermatomyositis: case and literature review. Clin Rheumatol. 2009 Apr 10. Epub ahead of print. [PubMed]
10. Alexander S, John GT, Jesudason M, Jacob CK. Infections with atypical mycobacteria in renal transplant recipients. Indian J Pathol Microbiol. 2007; 50(3):482-4. [PubMed]
11. Drouineau O, Rivault O, Le Roy F, Martin-Passos E, Young P, Godin M. Cutaneous infection due to Mycobacterium chelonae in a hemodialysed patient. Nephrol Ther. 2006;2(3):136-9. [PubMed]
12. Street ML, Umbert-Millet IJ, Roberts GD, Su WP. Nontuberculous mycobacterial infections of the skin. Report of fourteen cases and review of the literature. J Am Acad Dermatol. 1991;24:208-15. [PubMed]
13. Lamb SR, Stables GI, Merchant W. Disseminated cutaneous infection with Micobacterium chelonae in a patient with steroid-dependent rheumatoid arthritis. Clin Exp Dermatol 2004;29:254-7 [PubMed]
14. Wallace RJ, Tanner D, Brennan PJ, Brown BA. Clinical trial of clarithromycin for cutaneous (disseminated) infection to Mycobacterium chelonae. Ann Intern Med 1993;119(6): 482-6 [PubMed]
© 2010 Dermatology Online Journal

